纳米诱导剂通过线粒体自噬重塑肿瘤免疫微环境
2025-05-27 10:03
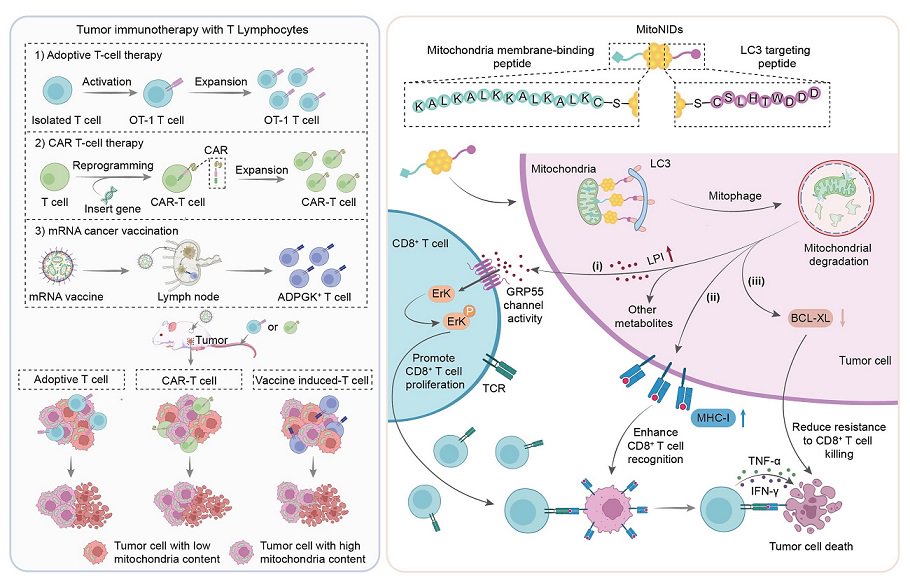 CD8 T细胞是免疫系统中的细胞毒性淋巴细胞,可以通过释放细胞毒素并激励靶细胞死亡,从而有效地清除感染或异常细胞。作为切割免疫疗法的一种方式,CD8 T细胞疗法使成功发展。但是,肿瘤微环境通常通过签署标志和免疫逃生机制,严重防止其治疗作用来限制CD8 T细胞的运行,并已成为当前免疫疗法面临的重大挑战。最近,国家纳米科学中心的研究人员王海团队发现,肿瘤细胞中线粒体的含量与其对杀死CD8 T细胞的敏感性有关。线粒体含量低的肿瘤细胞更有可能被CD8 T细胞杀死,而线粒体的高含量更可能生存。基于这一现象,研究小组开发了一种纳米引体,可以在肿瘤细胞中选择线粒体,从而增强了S杀死CD8 T.细胞的特定功能。这种创新方法已大大提高了各种免疫疗法方法的有效性。相关研究结果已发表在《自然纳米技术》杂志上,标题为“纳米诱导者介导的线粒体运动降解,可改善对许多癌症的T细胞免疫疗法”。研究团队开发的纳米诱导剂(Mitonids)可能会通过接近诱导的作用促进线粒体对蛋白相关的LC3蛋白的结合,从而导致选择性线粒体对自噬途径的肿瘤细胞Bytan的选择性。研究发现,一方面,肿瘤细胞中包含的线粒体诱导的线粒体是I类中主要组织相容性复合物(MHC-I)的表达,从而促进了抗原表现的效率。另一方面,它抑制了抗吞噬蛋白BCl-XL,削弱了肿瘤细胞的抗凋亡能力,因此LY增强其对CD8 T细胞介导的免疫杀伤的敏感性。 In addition, the mitonids-mediated mitochondrial degradation can also change the metabolic status of tumor cells, promote the release of lysophosphalaidylinositol (LPI) to activate the G protein-coupled receptor 55 (GPR55) -Rerk signaling pathway of CD8 t cells, and improved activation and improvement cells, of CD8 T. In Vivo experiments that have proven that the通过调节线粒体降解,有丝氨酸的抗肿瘤疗法显着增强了MRNA的产卵T细胞疗法,CAR-T细胞疗法和个性化疫苗。总的来说,这项在这项研究中设计的纳米引体可以调节肿瘤细胞中的线粒体代谢可以通过许多机制来增强CD8 T细胞的细胞毒性反应,从而为癌症免疫疗法提供新的思想和前景。潘Xueting是国家纳米科学中心的博士后,王智汉(Wang Zhihan本文的联合首先作者,研究人员王海只是本文的本文之一。该研究得到了中国国家自然科学基金会等项目的支持。 ?原始链接:https://www.nature.com/articles/s41565-025-01909-0
CD8 T细胞是免疫系统中的细胞毒性淋巴细胞,可以通过释放细胞毒素并激励靶细胞死亡,从而有效地清除感染或异常细胞。作为切割免疫疗法的一种方式,CD8 T细胞疗法使成功发展。但是,肿瘤微环境通常通过签署标志和免疫逃生机制,严重防止其治疗作用来限制CD8 T细胞的运行,并已成为当前免疫疗法面临的重大挑战。最近,国家纳米科学中心的研究人员王海团队发现,肿瘤细胞中线粒体的含量与其对杀死CD8 T细胞的敏感性有关。线粒体含量低的肿瘤细胞更有可能被CD8 T细胞杀死,而线粒体的高含量更可能生存。基于这一现象,研究小组开发了一种纳米引体,可以在肿瘤细胞中选择线粒体,从而增强了S杀死CD8 T.细胞的特定功能。这种创新方法已大大提高了各种免疫疗法方法的有效性。相关研究结果已发表在《自然纳米技术》杂志上,标题为“纳米诱导者介导的线粒体运动降解,可改善对许多癌症的T细胞免疫疗法”。研究团队开发的纳米诱导剂(Mitonids)可能会通过接近诱导的作用促进线粒体对蛋白相关的LC3蛋白的结合,从而导致选择性线粒体对自噬途径的肿瘤细胞Bytan的选择性。研究发现,一方面,肿瘤细胞中包含的线粒体诱导的线粒体是I类中主要组织相容性复合物(MHC-I)的表达,从而促进了抗原表现的效率。另一方面,它抑制了抗吞噬蛋白BCl-XL,削弱了肿瘤细胞的抗凋亡能力,因此LY增强其对CD8 T细胞介导的免疫杀伤的敏感性。 In addition, the mitonids-mediated mitochondrial degradation can also change the metabolic status of tumor cells, promote the release of lysophosphalaidylinositol (LPI) to activate the G protein-coupled receptor 55 (GPR55) -Rerk signaling pathway of CD8 t cells, and improved activation and improvement cells, of CD8 T. In Vivo experiments that have proven that the通过调节线粒体降解,有丝氨酸的抗肿瘤疗法显着增强了MRNA的产卵T细胞疗法,CAR-T细胞疗法和个性化疫苗。总的来说,这项在这项研究中设计的纳米引体可以调节肿瘤细胞中的线粒体代谢可以通过许多机制来增强CD8 T细胞的细胞毒性反应,从而为癌症免疫疗法提供新的思想和前景。潘Xueting是国家纳米科学中心的博士后,王智汉(Wang Zhihan本文的联合首先作者,研究人员王海只是本文的本文之一。该研究得到了中国国家自然科学基金会等项目的支持。 ?原始链接:https://www.nature.com/articles/s41565-025-01909-0 相关推荐
Copyright © 2024-2026 澳门吉尼斯人游戏平台 版权所有





 +86-123-4567
+86-123-4567 天朝天堂路99号
天朝天堂路99号